Des édifices ordonnés : les cristaux

Ce chapitre est étudié dans le cadre du thème » une longue histoire de la matière » du programme de première générale.
Objectifs du chapitre
- comprendre l’état cristallin de la matière
Mots clés : Solides cristallins, structures cristallines, solide amorphe, cristallographie, cristaux, système cristallin, minéraux, structure cubique, paramètres de maille, masse volumique, minéralisation, ossification, protection, coquille, raphides, glandes à sels, calculs rénaux, calcite, aragonite, oxalate de calcium, cristaux liquides.
Introduction
Dans le cadre de ce chapitre, nous étudierons une autre forme de l’organisation de la matière : l’état cristallin.
Le Chlorure de sodium (NaCl) solide est un exemple d’état cristallin, il est constitué d’un empilement régulier d’ions. Ainsi, les structures cristallines sont présentes dans la vie quotidienne. La neige, le sucre, les sels, de nombreuses roches sont des exemples de matières en état cristallin.
On peut aussi trouver des structures cristallines dans certains organismes biologiques. Par exemple le calcul rénal, les squelette, ainsi que les coquilles contiennent des structures cristallines.
Vocabulaire
Cristal : Un cristal est un solide qui peut être constitué d’atomes, d’ions ou de molécules.
Maille : en cristallographie, une maille correspond à une unité de répétition par translation. C’est une forme géométrique qui se répète de manière régulière pour former un cristal.
Structure cristalline : Une structure cristalline est définie par une maille élémentaire répétée périodiquement. A l’échelle microscopique, les cristaux, ou solides cristallins, ne n’ont pas tous des organisations identiques.
Réseau cristallin : Un réseau cristallin est le résultat de la répétition, dans les trois directions de l’espace, de la maille cristalline élémentaire.
Cristal ionique : cristal dans lequel les liaisons sont essentiellement des interactions électrostatiques entre ions de charges opposées.
Métamorphisme : transformation des minéraux d’une roche à l’état solide, du fait d’un changement des conditions de pression et de température, sans changement majeur de la composition chimique.
Les structures cristallines
Il existe différents types de structures cristallines, dans le cadre du programme de première, nous focaliserons sur les deux structures cubiques suivantes :
- La structure cubique simple (C)
La structure cristalline la plus connue est celle appelée structure cubique simple. Dans cette structure, les atomes sont situés aux 8 sommets d’un cube.
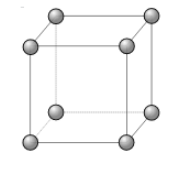
La multiplicité Z (nombre d’atomes dans une maille) = 8 * 1/8 =1
- La structure cubique à face centrées (CFC)
Dans cette structure, les atomes sont situés :
- aux 8 sommets d’un cube ;
- au centre de chaque face du cube.
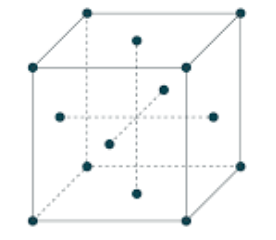
La multiplicité Z (nombre d’atomes dans une maille) =4
Les différents types de solides
Nous distinguons deux grandes familles de solides : les solides amorphes et les solides cristallins.
- Solide cristallin : Les solides cristallins sont constitués d’une répétition quasi parfaite de l’arrangement des atomes dans les 3 directions de l’espace.
- Solide amorphe : Les solides amorphes correspondent à un état liquide figé et pour lesquels l’ordre à longue distance n’existe pas.
Ces deux types de solides se distinguent par leurs propriétés. A l’échelle microscopique, les atomes d’un solide cristallin sont ordonnés , alors les atomes d’un solide amorphe sont désordonnés. A l’échelle macroscopique, ces deux de solides se distinguent par certaines de leurs propriétés.
Masse volumique d’un cristal
La masse volumique d’un cristal est donnée par :

Masse d’un ion sodium m(Na+ ) = 3,8.10-23 g
Masse d’un ion chlorure m(Cl – ) = 5,9.10-23 g
Longueur des côtés a = 564 pm
Nous rappelons que la masse volumique, dont le symbole est ρ (rhô), est une propriété qui représente la quantité de matière (masse) se trouvant dans un espace (une unité de volume) donné.
Paramètre de la maille
On appelle paramètre de la maille, noté a, la longueur de l’arête du cube.
Volume de la maille : a * a * a = a3
La compacité d’un cristal
La compacité d’un cristal est le rapport du volume total des sphères des entités chimiques d’une maille par le volume de cette maille. Cette dernière représente le taux de remplissage de la maille par les sphères des entités chimiques.

Remarque : La compacité est une grandeur sans unité.
Exemple d’application
Calculer la compacité du cristal de polonium à l’aide des données suivantes. On rappelle que le polonium cristallise selon une structure cubique simple.
Données :
a = 3,36×10-10 m
RP0 =1,68×10-10m
Solution
Etape 1 : On exprime le volume de la maille grace au paramètre de la maille a.
Vmaille = a*a*a = a3
a: étant la longueur de l’arete du cube.
Etape 2 : On exprime le volume des atomes présents dans la maille. Pour cela on doit déterminer le nombre d’atome qui se trouvent à l’intérieur de la maille. On calcule donc la multiplicité Z ensuite on multiplie le nombre d’atomes par maille par le volume d’un atome.
Pour une structure cubique simple, la multiplicité Z est donnée par : 8*1/8 = 1
On a Vatomes = Z*Vatome
Questions pour la révision
- D’où vient le chlorure de sodium ?
Réponse : Le Chlorure de Sodium est présent dans les roches ou issu de l’évaporation de l’eau de mer. - les solides cristallins (ou les cristaux) ont-ils des organisations toutes identiques à l’échelle microscopique ?